Come fare
Il metodo di prova per l’analisi dei residui dei pesticidi è un documento che riporta le modalità per l’esecuzione della prova in Laboratorio.
Trattasi di un metodo di prova:
- relativo: perchè la risposta ottenuta, con uno o più strumenti tarati e indicati nel metodo, deve essere confrontata con quella dei materiali di riferimento certificati;
- razionale: in quanto l’analita/i (es.: pesticidi, ecc.) è una entità chimica definita, di cui si valuta la sua concentrazione totale nel prodotto da provare ed il risultato finale può essere ottenuto anche con altre procedure, pure razionali, oltre al metodo di prova in uso [13].
Il metodo di prova può:
- contenere poche e concise informazioni su come eseguire le attività, scritte in modo tale da poter essere utilizzate dal personale di laboratorio;
- avere la necessità di essere integrato con informazioni e descrizioni aggiuntive per descrivere passaggi opzionali all’interno del metodo o dettagli supplementari.
In quest’ultimo caso si fa riferimento a una procedura di prova, ossia un documento che integra i metodi di prova normalizzati carenti o, descrivere, al punto di diventare autoportante, un metodo sviluppato internamente dal Laboratorio.
Tutto questo è previsto dalla norma UNI CEI EN ISO/IEC 17025:2018 che riporta:
"... quando necessario, l'applicazione del metodo deve essere integrata con dettagli supplementari per assicurare una regolare e coerente applicazione".
La citata norma UNI CEI EN ISO/IEC 17025:2018 raccomanda ai Laboratori di usare uno o più metodi di prova pubblicati in:
- norme internazionali;
- norme regionali o nazionali;
- da organizzazioni tecniche autorevoli;
- in testi o riviste di rilevanza scientifica;
- indicati dal costruttore delle apparecchiature.
La stessa norma indica che si può usare anche un metodo di prova sviluppato o modificato internamente dal Laboratorio.
Inoltre, la UNI CEI EN ISO/IEC 17025:2018 indica che il laboratorio, una volta individuato il metodo di prova, idoneo per l’analisi, lo deve essere comunicare al Cliente, a meno che non sia stato quest’ultimo ad indicarlo al Laboratorio.
Metodo di prova: quale scegliere?
Il regolamento tecnico RT-08, di Accredia, fornisce le seguenti indicazioni, quindi con valenza anche per il metodo di prova per l’analisi dei residui dei pesticidi [1]:
- metodo ufficiale: è riportato o richiamato in documenti normativi cogenti (es.: leggi, decreti, regolamenti) e/o pubblicato su Gazzetta Ufficiale dell’Unione Europea (GUCE), o Italiana (GU) o comunque richiamato o riportato in un documento emesso da una Autorità Competente (es. Ministero, Regione, Provincia, ecc.).
- Si rammenta che un metodo di prova ufficiale è una caratteristica indipendente dal grado di esaustività del suo contenuto.
- metodo normalizzato: si fa riferimento ad un metodo di prova approvato da organismi:
- di normazione nazionali, europei o internazionali (ad es.: metodi UNI, CEI, CEN, ISO, UNICHIM, ecc.);
- da organismi pubblici autorevoli (es.: USDA, FDA, EPA, IUPAC, ecc.).
- metodo non normalizzati: è un metodo che di solito è:
- emesso da organizzazioni tecniche nazionali o internazionali;
- sviluppato da Laboratori/centri di riferimento nazionali o comunitari o da centri di referenza nazionali accreditati;
- Uno degli elementi discriminanti, rispetto ai metodi normalizzati, è che la responsabilità dei dati forniti è riferita non all’organizzazione che lo ha emesso, ma ai singoli autori.
- metodo interno: rientra in questa categoria un metodo di prova adottato da un Laboratorio sulla base di conoscenze desunte dalla letteratura scientifica e/o dall’esperienza pratica. Il metodo interno può essere:
- sviluppato interamente dal Laboratorio;
- un metodo normalizzato applicato diversamente da quanto specificato (es.: validato su frutta, e applicato sull’olio di oliva, ecc.);
- tratto da riviste o pubblicazioni scientifiche;
- tratto da documenti tecnici allegati ad apparecchiature o prodotti per le prove;
- un metodo non normalizzato modificato a seguito di particolari esigenze interne al Laboratorio.
Metodo di prova per l’analisi dei residui dei pesticidi: alcune indicazioni
Prima dell’anno 2000, i metodi di prova in uso presso i Laboratori, pubblici e privati, per il controllo dei residui dei pesticidi erano prevalentemente interni.
Fatto salvo alcuni casi (es.: Ditiocarbammati), in assenza di metodi ufficiali, i Laboratori si adoperavano per lo sviluppo di uno, o più metodi di prova, consultando i numerosi riferimenti scientifici di settore.
Fu con il Regolamento 882/2004, ora sostituito dal Reg. 625/2017, che si fece un notevole salto di qualità. Infatti, al considerando 17 del regolamento si legge:
"I Laboratori che partecipano all'analisi di campioni ufficiali dovrebbero operare secondo procedure approvate internazionalmente o a norme di efficienza basate su criteri e usare metodi di analisi che siano stati convalidati nei limiti del possibile. Detti Laboratori dovrebbero in particolare disporre di attrezzature che consentano la corretta determinazione di standard quali i livelli massimi di residui fissati dalla normativa comunitaria".
Inoltre, sempre con il citato regolamento sono istituiti i Laboratori di riferimento, comunitari e nazionali. Infatti, al considerando 18 si legge:
"La designazione di Laboratori di riferimento, comunitari e nazionali, deve contribuire ad assicurare un'elevata qualità e uniformità dei risultati analitici. Tale obiettivo può essere raggiunto mediante attività quali l’applicazione di metodi analitici convalidati, l’assicurazione che siano disponibili materiali di riferimento, l’organizzazione di test comparativi e la formazione del personale di Laboratorio."
e ancora al considerando 20:
"Per diverse attività legate ai controlli ufficiali, il Comitato europeo di normalizzazione (CEN) ha sviluppato norme europee (norme EN) appropriate .... Queste norme EN concernono in particolare il funzionamento e la valutazione dei Laboratori che eseguono i test e il funzionamento e l'accreditamento degli organismi di controllo..."
In altre parole, l’Unione Europea ha voluto intervenire sull’intera filiera del controllo ufficiale.
Lo scopo è stato quello di armonizzare i comportamenti fra i Laboratori, fare sistema tra i Laboratorio nell’Unione Europea a garanzia della qualità del dato e per la confrontabilità del risultato.
Il cambiamento

Quello che è avvenuto con l’emissione del Reg. 882/2004 è stato un cambiamento estremamente importante, oserei dire quasi epocale. L’Unione Europea (UE) ha voluto intervenire sulle modalità di effettuare il controllo ufficiale apportando elementi di standardizzazione.
L’Autorità competente (Regione/Provincia Autonoma) designa i Laboratori che possono eseguire le analisi dei campioni dei controlli ufficiali. Possono designare solo Laboratori che dispongono di metodi di prova accreditati.
Per assicurare un’elevata qualità, i Laboratori devono:
- usare metodi di prova accreditati;
- disporre di materiali di riferimento;
- partecipare ai test comparativi (Proficiency test) obbligatori organizzati dai Laboratori di riferimento: comunitari e nazionali;
- adoperarsi per una idonea formazione del loro personale.
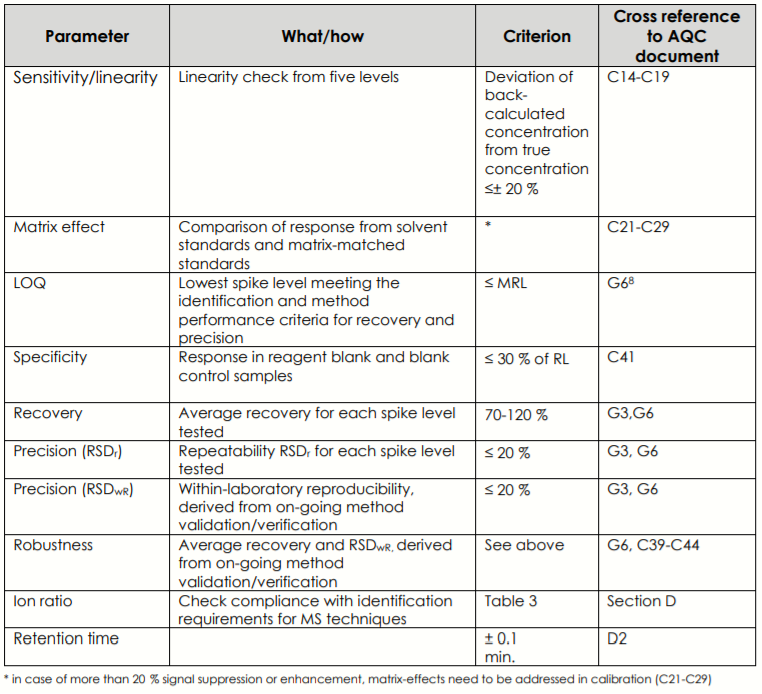
I metodi di prova ed i risultati delle misurazioni devono essere caratterizzati dai criteri di cui ai parametri riportati nell’immagine 1.
In altre parole, il Laboratorio che intende usare un metodo di prova deve procedere ad una validazione prima del suo utilizzo nell’attività di controllo.
Inoltre, sempre per effetto del Reg. 882/2004 ed in ordine di priorità, i metodi di prova devono essere:
- ... conformi a pertinenti norme o protocolli riconosciuti internazionalmente, compresi quelli accettati dal comitato europeo di normalizzazione (CEN); - sviluppati o raccomandati dai Laboratori di riferimento dell’Unione europea e convalidati in base a protocolli scientifici accettati internazionalmente.
In assenza di metodi di prova con le caratteristiche riportate, la norma prevede di dare priorità a metodi di prova:
- conformi alle norme pertinenti definite a livello nazionale; - ... sviluppati o raccomandati dai Laboratori di riferimento dell’Unione Europea e convalidati in base a protocolli scientifici accettati internazionalmente; - ... sviluppati e approvati da studi inter o intra Laboratorio sulla convalida dei metodi in base a protocolli scientifici accettati internazionalmente.
SANTE 11312/2021
L’Unione Europea ha predisposto il documento di cui al punto [2] della bibliografia, ossia il SANTE 11312/2021. Nel sito web dell’EURL è sempre disponibile nella versione più aggiornata. Mediamente viene aggiornato ogni due anni.
Si applica ai laboratori che effettuano il controllo ufficiale dei residui di pesticidi negli alimenti e nei mangimi.
Tale guida è complementare e integra i requisiti della ISO 17025. La sua applicazione da parte dei Laboratori dovrebbe essere valutata durante gli audit e gli accreditamenti dei Laboratori ufficiali sui residui di pesticidi [2].
Questo documento descrive i requisiti di validazione del metodo di prova ed il controllo di qualità analitica (AQC) per supportare la validità dei dati riportati nell’ambito dei controlli ufficiali sui residui di pesticidi.
Relativamente alla validazione il documento SANTE riporta i criteri di accettabilità per alcuni dei parametri riportati nell’immagine 1 precedente (vedi immagine 2). Ovviamente le specifiche riportate si intendono per ciascun analita oggetto di controllo ufficiale e specificato nel metodo di prova.
Come già è stato anticipato il Regolamento 882/2004 è stato abrogato dal Regolamento 625/2017. Tale norma Europea ha conservato ed ampliato gli aspetti funzionali ad un miglioramento del controllo ufficiale in un contesto tale da assicurare un’elevata qualità e uniformità dei risultati analitici.
Metodo di prova e qualità
Quando il Cliente non indica quale metodo di prova il Laboratorio deve usare per soddisfare le richieste analitiche, il Laboratorio stesso individua, fra i possibili, un criterio di scelta. Ad esempio, si attiene alla seguente regola di priorità tra i metodi:
- ufficiali;
- normalizzati;
- non normalizzati;
- interni.
E’ importante sottolineare che l’impiego di metodi di prova, riconducibili ai punti 1 e 2, collocano il Laboratorio in un ambito di un limitato rischio. In altre parole, trattasi di metodi più strutturati (es.: norme: UNI, ISO, ecc.), dove altri Laboratori già hanno valutato le performance (es.: ripetibilità e riproducibilità), solitamente riportate. In questo caso il Laboratorio, che intende usare il metodo di prova, deve eseguire prove di verifica, documentarle, per valutarne l’applicabilità per gli scopi previsti (vedi articolo: validazione di un metodo di prova).
Per i metodi di cui ai punti 3 e 4, comunque permessi dalla norma, il Laboratorio deve effettuare la validazione, come previsto dalla ISO 17025, per confermare le performance ed i criteri di accettabilità indicati nello studio di fattibilità (progettazione). Qualora trattasi di metodi di prova per il controllo ufficiale il Laboratorio deve rispettare le specifiche indicate dalle norme di settore (es.: Reg. 625/2017; D.Lgs. 219/2010; D.Lgs. 31/2001; DM 14/06/2017; ecc.).
…. e ancora
Si sottolinea che la scelta di un metodo di prova deve comunque essere preceduta da uno studio di fattibilità (progettazione) nel quale diventano prioritari definire alcuni elementi. In altre parole si devono dettagliare le specifiche in:
- ingresso (es.: scopo, campo di applicazione, requisiti normativi, riferimenti bibliografici, strumentazione, personale, proficiency test, validazione, costi, ecc.)
- uscita (es.: addestramento del personale, disponibilità strumentale e caratteristiche prestazionali, prodotti, materiali di riferimento, ecc.).
E’ fondamentale che il Laboratorio individui un metodo o una procedura di prova, appropriato e tale da soddisfare le richieste del Cliente.
Qualora sia stato il Cliente medesimo a richiedere un determinato metodo di prova, il Laboratorio deve informarlo se tale metodo risulta inappropriato o obsoleto (p.to 7.1.2 UNI CEI EN ISO/IEC 17025:2018).
Riesame e validazione
Il responsabile del Laboratorio, o dello studio di fattibilità/progetto del metodo di prova, verifica la coerenza dei contenuti dello studio prima di iniziare il programma operativo che prevede anche la validazione.
Qualora uno o più elementi oggetto di verifica diano un esito negativo, il Responsabile effettuerà un riesame (o più riesami se necessario) delle varie fasi di studio (vedi articolo: validazione di un metodo di prova) al fine di accertarne la fattibilità e, soprattutto, l’idoneità. In questo contesto vengono definite anche le eventuali azioni correttive allo scopo di raggiungere l’obiettivo.
Seguirà la validazione con la scrittura della bozza della procedura di prova, se necessaria, e del documento di validazione che evidenzia, nel dettaglio, i risultati conseguiti per i vari livelli di concentrazione. Tale documento deve essere corredato da eventuali fogli di calcolo a loro volta validati.
Per i metodi di prova:
- non normalizzati;
- interni;
- normalizzati usati al di fuori dello scopo e campo di applicazione definito;
- estensioni e modifiche di metodi normalizzati;
si registra la dichiarazione di idoneità del metodo/procedura per l’uso previsto.
Qualora una procedura di prova precedentemente validata venisse modificata in maniera sostanziale (es.: un diverso solvente di estrazione, una differente tecnica di misura, ecc.), si valuta, se del caso, una nuova progettazione e sicuramente una nuova validazione.
Sito web EURL
L’UE ha messo a disposizione un, ricco e completo, sito web: EURL nel quale, oltre alla pagina “Portale EURL”, ne sono presenti altre quattro denominate: “EURL per:
- Frutta e verdura
- Cereali e mangimi
- Alimenti di origine animale
- metodi a residuo singolo”
Tale suddivisione rende molto fruibile l’accesso ed al ritrovamento delle informazioni.
E’ un sito ricco di contenuti e molto utile ai Laboratori. E’ nato per accompagnare il Laboratorio nell’esecuzione della propria attività fornendo concrete risposte in un settore, non facile e, soprattutto, in continua evoluzione.
Troviamo:
- i documenti per il Quality control (QC);
- le indicazioni sui proficiency test obbligatori a cui i Laboratori devono partecipare;
- i metodi di prova: sia multiresiduo che single residual method (SRM) arricchiti dai dati di validazione;
- l’elenco degli analiti da ricercare come da programmi pluriennali di controllo dei residui di pesticidi (MACP);
- indicazione degli strumenti per effettuare le analisi.
Consultando anche l’EURL DataPool troviamo informazioni riguardanti:
- un’ampia raccolta di dati di convalida provenienti da vari laboratori che utilizzano metodi di prova diversi;
- una raccolta di dati sulla stabilità degli standard analitici;
- Masse e spettri GC-MS;
- Transizioni di massa LC-MS/MS;
- Masse accurate LC-ToF per ioni genitori e figli;
- le proprietà fisico-chimiche analiticamente più rilevanti dei pesticidi;
- uno strumento per il calcolo dei livelli di residuo espressi nella definizione del residuo sulla base dei risultati dei singoli componenti;
- ecc.
Queste pagine web sono in continua evoluzione per fornire idonee risposte ad una complessa tematica.
QuEChERS

Il metodo di prova conosciuto come QuEChERS è stato sviluppato dal Dr. Michelangelo Anastassiades negli anni 2001 e 2002.
Con l’acronimo QuEChERS si fa riferimento:
- Quick (Rapido)
- Easy (Facile)
- Cheap (Economico)
- Effective (Efficace)
- Rugged (Robusto, rigoroso)
- Safe (Sicuro)
ossia un approccio analitico semplificato per l’analisi dei residui dei pesticidi in frutta, verdura, cereali e prodotti trasformati.
La procedura comporta una serie di fasi, da condurre in successione, semplici e veloci, di facile esecuzione e quindi poco suscettibile di errori. Il metodo QuEChERS fornisce recuperi adeguati ad un elevato numero di pesticidi e l’estratto finale, essendo raccolto in un piccolo volume di acetonitrile, consente di scegliere la tecnica di analisi: solitamente cromatografia liquida e gassosa [5].
Questo metodo di prova ebbe subito un grandissimo seguito tra i Laboratori. Probabilmente il grande successo è dovuto alle seguenti motivazioni:
- facilità di esecuzione;
- sicurezza per l’operatore;
- limitato consumo di materiale e reattivi;
- eliminazione di complessi, lunghi e, talvolta, critici sistemi di purificazione;
- elevata produttività;
- costi contenuti;
- limitati tempi di risposta analitica.
Nel sito web del CVUA di Stoccarda [7] si conferma che con il metodo Quechers si ha:
- elevata produttività nella preparazione del campione: 8 campioni in circa 30 minuti per Operatore;
- bassi costi: circa 1 € di fabbisogno di materiale per campione per la preparazione;
- riduzione nella produzione di rifiuti (es.: solventi);
- spazi limitati per l’applicazione del metodo di prova.
Oggi è, probabilmente, l’approccio di preparazione del campione più utilizzato nell’analisi dei residui di pesticidi in tutto il mondo [5].
La norma UNI CEI EN ISO/IEC 17025:2008 è stata ritirata nel maggio del 2018 e sostituita dalla migliorata norma UNI CEI EN ISO/IE 17025:2018. Quest’ultima norma riporta:
- dati di precisione: sono riassunti in CEN/TR 17063:2017
- le linee guida per la taratura sono delineate in UNI CEN/TS 17061:2019
Metodo di prova per l’analisi dei residui dei pesticidi negli alimenti di origine vegetale
Il citato metodo QuECheRS è stato presentato per la prima volta, nel 2002, a Roma nel Workshop Europeo sui residui di pesticidi (EPRW) da: M. Anastassiades, SJ Lehotay, D. Stajnbaher e FJ Schenck.
Presentarono un metodo multiresiduale, facile e veloce, per la determinazione dei residui di pesticidi nei prodotti di origine vegetale. Il Metodo prevede un’estrazione/partizione con acetonitrile ed estrazione dispersiva in fase solida [3]. Venne pubblicato per la prima volta nel 2003 [4].
Il Laboratorio di riferimento per la Frutta e Verdura di Stoccarda (CVUA), ha usato il metodo di prova in routine dal 2002 e nel 2004, per la prima volta, per l’esecuzione dell’EUPT4 con risultati soddisfacenti [5].
Negli anni successivi, il metodo originale è stato modificato, ampliando sia il numero dei pesticidi che dei prodotti. Sono stati introdotti i sali tampone, per migliorare i recuperi degli analiti pH-dipendenti (es.: acidi fenossialcanoici, pesticidi labili in condizioni alcaline e acide) [6].
Nel 2008, il CVUA di Stoccarda ha inserito nel metodo di prova il tampone a base di sali di citrato per l’analisi dei pesticidi in prodotti difficili e quindi ha pubblicato il metodo di prova che è diventata la norma europea EN 15662:2008 [7].
Tale norma descrive un metodo di prova per l’analisi dei residui di pesticidi negli alimenti di origine vegetale, come frutta (compresa la frutta secca), ortaggi, cereali e prodotti trasformati. Il metodo è stato studiato per una sua applicazione su un gran numero di combinazioni prodotti/pesticidi.
Per l’applicazione del metodo, i Laboratori hanno effettuato le loro prove di validazione generando una grande quantità di dati. Questi dati sono stati raccolti in uno specifico database, inserito nella pagina web EURL-datapool.
Per un numero elevato, oltre 600, di pesticidi e metaboliti, il sito web EURL-datapool riporta informazioni importanti per i Laboratori (es.: il recupero, livelli di concentrazione, tecnica analitica, ecc.).
Metodi a singolo residuo (SRM)
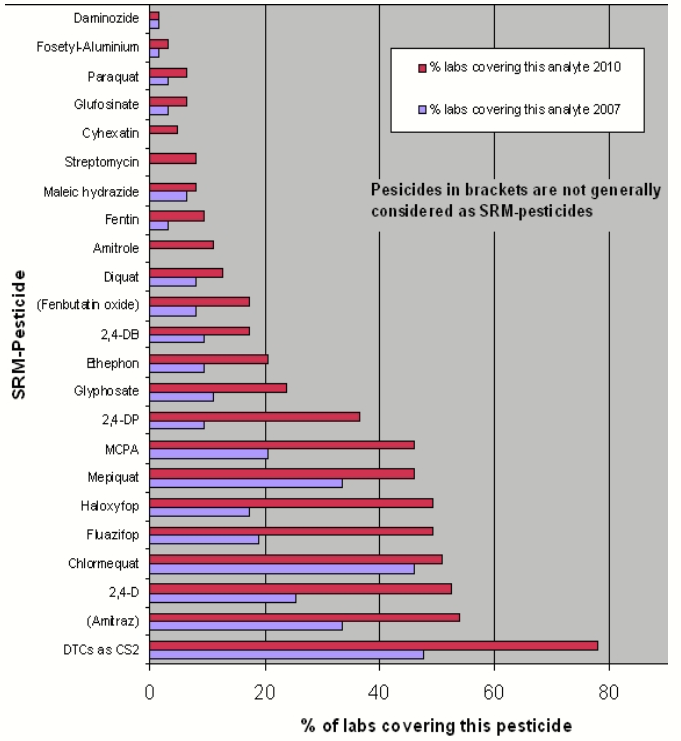
Tra i pesticidi rientrano sostanze chimiche che tradizionalmente non sono analizzabili con un metodo di prova multiresiduo (MRM).
I metodi di prova a residuo singolo (SRM) sono in genere laboriosi e costosi quanto i MRM, ma coprono solo uno o un numero limitato di pesticidi. Attualmente sono stati proposti circa 50 SRM.
L’inserimento di un pesticida SRM nello scopo analitico di un Laboratorio richiede, in genere, uno sforzo molto maggiore rispetto all’inclusione di un composto in un metodo di prova MRM esistente. C’è un lavoro aggiuntivo per la validazione del nuovo metodo, la sua implementazione nel sistema di qualità, la partecipazione ai PT e la successiva applicazione in routine. Questo potrebbe determinare la necessità di risorse aggiuntive di personale e di strumentazione.
Per queste motivazioni i Laboratori sono restii a introdurre i pesticidi a SRM nei loro scopi.
Per contro c’è un vantaggio nel sistema di controllo ufficiale inserendo i metodi di prova SRM. Infatti, si potrebbero avere informazioni sui residui per uno o più pesticidi che rappresentano un certo rischio per i consumatori. Peraltro, in questo caso, si andrebbe ad accrescere la limitata conoscenza sui dati dei residui di alcuni pesticidi nei prodotti vegetali.
L’EURL ha creato una pagina web specifica per i SRM, dove reperire metodi e/o indicazioni per impostare le procedure di prova.
L’EURL riporta che i metodi forniti sono da considerarsi un servizio piuttosto che una prescrizione su come eseguire le analisi. Inoltre, precisa che i Laboratori sono liberi di utilizzare qualsiasi metodo a loro piacimento purché siano soddisfatti i criteri di prestazione stabiliti nel documento Sante 12682/2019.
Tutti i metodi sviluppati dall’EURL-SRM sono stati validati internamente. Il metodo per i pesticidi acidi è stato validato in uno studio interlaboratorio.
QuPPe
Tra le numerose applicazioni SRM, si segnala quello indicato con QuPPe (Quick, Polar, Pesticides). Trattasi di un metodo, rapido ed economico, per la determinazione simultanea di un gran numero di pesticidi altamente polari e quindi non rientranti nel QuEChERS tradizionale (log Kow < -2 circa).
Si fa riferimento, ad esempio, alle seguenti sostanze attive: glifosato, N-acetil-glifosato, AMPA, N-acetil-AMPA, glufosinato, MPPA, N-acetil-glufosinato, fosetil-alluminio, acido fosfonico, perclorato, clorato, bromuro, acido trifluoroacetico, Acido cianurico, idrazide maleica, ecc.
I residui delle sostanze attive vengono estratte dal campione oggetto di prova, frantumato e omogeneizzato, con metanolo acidificato, se necessario dopo l’aggiunta di standard marcati, e determinati quali e quantitativamente mediante analisi LC-MS/MS o in CI-MS/MS.
Il metodo QuPPe, in realtà, è una raccolta di vari metodi LC o IC-MS/MS che consentono l’analisi simultanea di diverse combinazioni di pesticidi. Questa raccolta è stata validata attraverso studi interlaboratorio.
Il metodo è in uso in molti Laboratori nel mondo ed è in fase di standardizzazione per opera del Laboratorio comunitario di riferimento.
Il metodo QuPPe è continuamente sviluppato e ampliato per includere ulteriori sostanze e tipi di prodotto.
Metodo di prova per l’analisi dei residui dei pesticidi a base di Ditiocarbammati
Il metodo di prova “Determinazione dei residui di ditiocarbammati e thiuram disolfuri in prodotti vegetali (DM 18/04/1981 GU n°155 08/06/1981)” pur rientrando tra quelli ufficiali, è molto datato.
Nel Reg. 396/2005, per il LMR alla voce ditiocarbammati é riportato: “Somma di Ditiocarbammati (comprendenti maneb, mancozeb, metiram, propineb, tiram e ziram), espresso come CS2”.
La tecnica analitica usata è quella spettrofotometrica. Consente di raggiungere prestazioni non più in linea con le esigenze dettate da una normativa sui LMR in evoluzione.
Per questa motivazione il metodo di prova dell’EURL – SRM è preferito a quello ufficiale.
Il documento proposto dal SRM descrive una procedura di prova per l’analisi gascromatografica dei residui di ditiocarbammati in prodotti ortofrutticoli e cerealicoli attraverso il loro comune prodotto di degradazione ossia CS2, come previsto dal Reg. 396/2005/CE.
La procedura di prova è impiegata nell’intervallo di concentrazione 0,04 – 1,0 mg/kg CS2. Tale procedura suggerisce di effettuare prove di recupero per ciascuna sequenza analitica. Il valore medio del recupero per CS2 deve essere compreso tra il 80 e il 120 %, come afferma il Sante 12682/2019.
Relativamente alla sostanza attiva Propineb, l’EURL propone uno SRM specifico. Infatti, nel 2009 è stato pubblicato un metodo GC, che viene usato dai Laboratori.
Consiste nel campionamento diretto dello spazio di testa, l’arricchimento SPME dello spazio di testa e ripartizione liquido-liquido in un solvente non polare, come isottano.
Metodo di prova per l’analisi dei residui dei pesticidi nelle acque
Come risaputo i prodotti fitosanitari, contenenti una o più sostanze attive, sono utilizzati per la lotta contro i parassiti delle piante e nel controllo delle infestanti nelle pratiche agronomiche. I residui di questi prodotti, ossia le sostanze attive (padre) ed i loro eventuali prodotti di degradazione (figli) possono finire nella risorsa acqua.
Il metodo di prova proposto nel Rapporto Istisan 19/7 è applicabile ad un elevato numero di residui di sostanze attive eventualmente contenute nelle acque.

Il campo di applicazione del metodo è riferito ad acque:
- da destinare e destinate al consumo umano;
- minerali naturali;
- termali e di sorgente;
- sotterranee e superficiali interne;
- utilizzate in produzione primaria e alimentare;
- utilizzate per la produzione di acque di dialisi;
- usate per fini ricreazionali (centri spa, piscine);
- per altre destinazioni d’uso;
previa dimostrazione (validazione) dell’ottenimento di prestazioni accettabili per gli analiti alle concentrazioni di interesse [9].
Il metodo di prova è pertanto da considerare idoneo all’impego per i controlli sulla qualità delle acque destinate al consumo umano di cui all’art. 11, comma 1, lettera d) del DLgs 31/2001.
Il metodo di prova è applicabile a tutte le sostanze attive analizzabili con tecnica multiresiduale. Le tecniche di misura sono:
- gascromatografia con analizzatori selettivi: GC-MS, GC-MSMS, HRMS, ecc.
- cromatografia liquida con analizzatore di massa LC-MSMS,HRMS; ecc.
L’estrazione delle sostanze attive, e/o dei metaboliti, eventualmente presenti nell’acqua avviene con l’impiego di:
- solid-phase extraction (SPE) con cartucce (tipo C-8 e tipo C-18);
- con cartucce di carbone grafitato;
Oppure, nel caso della cromatografia liquida [9], si può procedere per iniezione diretta o per arricchimento online usando colonne cromatografiche tipo C-8 e tipo C-18.
Glifosate, AMPA, glufosinate
Il glifosato o N-(phosphonomethyl)-glycin è uno degli erbicidi più usati al mondo. E’ una sostanza attiva di grande efficacia, a largo spettro soprattutto per quanto riguarda gli infestanti più persistenti.
Il glifosato è molto solubile in acqua (10.000 mg/l a 20°C) e quindi potrebbe raggiungere le acque superficiali (laghi e fiumi) e sotterranee (acque di falda). Il suo principale prodotto di degradazione è l’AMPA (Aminomethylphosphonic acid), molto più solubile in acqua (1.466.561 mg/l a 20°C fonte PPDB).
L’analisi strumentale di queste molecole risulta però difficoltosa a causa delle loro caratteristiche chimico-fisiche.
Le attuali metodiche analitiche per la determinazione del glifosato nelle acque prevedono l’utilizzo di tecniche cromatografiche (tipicamente GC o LC) accoppiate alla spettrometria di massa.
Nei Rapporti Istisan 19/7 [9] sono riportati tre distinti metodi di prova che fanno riferimento a:
- ISS.CBA.049.REV00. Glifosato, glufosinato e AMPA: metodo in derivatizzazione con FMOC-Cl, separazione con LC-HRMS e in LC-MSMS
- ISS.CBA.050.REV00. Glifosato, AMPA e glufosinato ammonio: metodo in derivatizzazione pre-colonna con ACCQ™-TAG e analisi strumentale in UPLC™-MSMS
ISS.CBC.001.REV00. Glifosato, AMPA e glufosinato: metodo IC-HRMS (iniezione diretta)
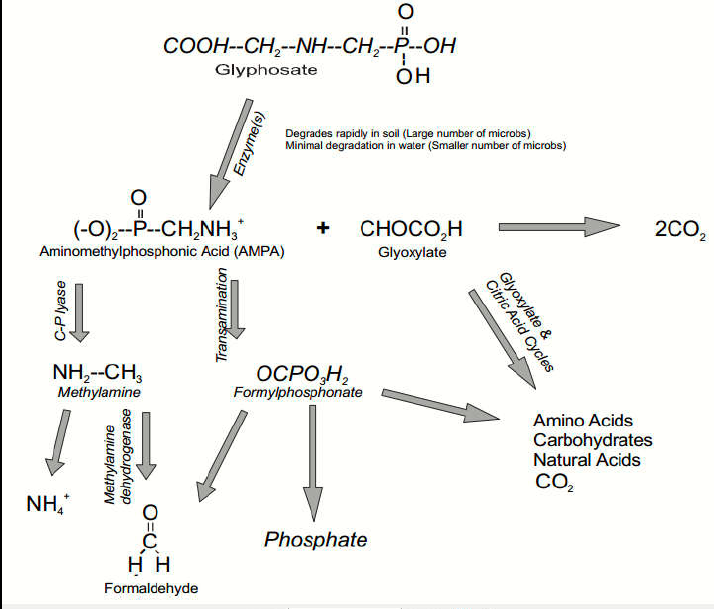
In conclusione, riportiamo nell’immagine 8 le possibili vie degradative del glifosato nell’ambiente. Inoltre, nel documento di cui al p.to [11] della bibliografia si legge:
“La principale via di decomposizione del glifosato nell’ambiente è attraverso la degradazione microbica nel suolo (Franz et al. 1997). L’erbicida è inattivato e biodegradato dai microbi del suolo a velocità di degradazione legate all’attività microbica nel suolo e ai fattori che influenzano questa attività (Eriksson, 1975)“.
Conclusione
A partire dal 2004, nell’Unione Europea è stata impostata una nuova modalità per i controlli ufficiali. E’ iniziata con il Reg. 882/2004, sostituito dopo oltre una decina di anni dal Reg. 625/2017. I Laboratori, preposti al controllo ufficiale, ed anche chi effettua autocontrollo, sono stati fortemente sensibilizzati ad un cambiamento allo scopo di favorire il “sistema” dei controlli in Europa.
E’ stato chiesto l’accreditamento dei metodi/procedure di prova, ossia attestazione di competenza nell’esecuzione dell’attività analitica.
I Laboratori devono partecipare obbligatoriamente ai proficiency test (PT). In altre parole, i Laboratori devono fornire evidenza oggettiva della qualità del dato analitico al Cliente ed in fase di Audit. Con la partecipazione ai PT, i Laboratori devono analizzare alcuni analiti obbligatoriamente.
Per contro, qualora non seguissero queste indicazioni, i Laboratori verrebbero classificati di “categoria B” nell’esecuzione dei PT, anche con un risultato, complessivo, soddisfacente.
Sono indicati gli analiti da ricercare sugli alimenti di origine vegetale, aspetto rilevante che determina l’efficacia del controllo. A tale proposito i Laboratori sono fortemente raccomandati a seguire tali indicazioni dalle autorità sanitarie (Ministero della Salute, Regioni/Province autonome).
Tutto questo è stato impostato per disporre in Europa di un sistema dei controlli degli alimenti di origine vegetale idoneo allo scopo, garantendone:
- l’efficacia attraverso vincoli normativi;
- la qualità del dato analitico attraverso la partecipazione obbligatoria ai PT ed i riferimenti del Sante 12682/2019.
Acqua
Diverso è l’approccio per il controllo ambientale.
La normativa di settore prevede un obbligo all’accreditamento (D.Lgs. 219/2010 art. 78-quinquies e DM 14.06.17, all. II, p.to 1) per il Laboratorio preposto al controllo delle acque e quindi alla partecipazione ai PT per ciascun metodo/procedura di prova. Pur essendo fortemente raccomandato dalla normativa in vigore e da documenti di settore:
- Manuali e Linee Guida Ispra 61/2010;
- Manuali e Linee Guida Ispra Arpa-Appa 71/2011;
- Linee Guida SNPA 14/2018;
la scelta degli analiti sembra non strutturata in tutti i Laboratori. Lo dimostra uno studio riportato al punto [12] della bibliografia nel quale si legge:
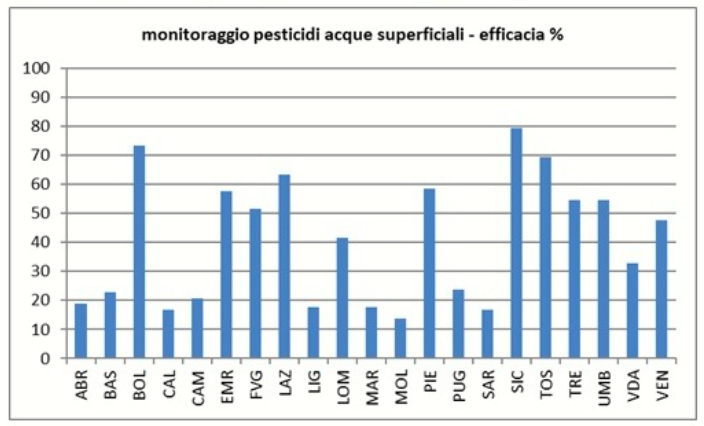
"Ispra aggiunge inoltre che, sebbene l’efficacia del monitoraggio sia cresciuta negli ultimi anni, in Italia il grado di contaminazione delle acque è sottostimato a causa delle difficoltà tecniche e metodologiche che caratterizzano l’analisi dei pesticidi. Quest’affermazione trova conferma da quanto emerge da una elaborazione che abbiamo effettuato applicando gli indirizzi contenuti nelle Linee guida del Sistema nazionale di protezione ambientale (Lg Snpa n°14/2018), tenendo conto dei risultati disponibili del monitoraggio nelle acque delle regioni italiane (fonte: dati Ispra anni 2017-18) e dei dati di vendita dei fitofarmaci degli ultimi anni nelle regioni italiane (fonte: dati Istat anni 2017-19)".
L’immagine 9 riporta il grafico che rappresenta l’efficacia del monitoraggio dei pesticidi delle acque superficiali.
Gli Autori sottolineano:
"Come noto la capacità di rappresentare il grado di contaminazione delle acque dai pesticidi è correlata al profilo di monitoraggio adottato, ossia alle sostanze analizzate. Se una sostanza attiva non viene ricercata è pacifico che non venga ritrovata. Il profilo di monitoraggio deve tenere conto delle sostanze attive impiegate nel proprio territorio e della probabilità di residuare nelle acque di ognuna di esse. Una adeguata efficacia del monitoraggio è un requisito minimo per poter misurare il grado di contaminazione delle acque da pesticidi."
Le considerazioni espresse sulla modalità di scelta degli analiti valgono anche per il controllo dell’acqua da destinarsi e destinata al consumo umano. Infatti nel D.Lgs. 31/2001 alla nota 6 dell’allagato I parte B parametri chimici si legge:
“Il controllo è necessario solo per gli antiparassitari che hanno maggiore probabilità di trovarsi in un determinato approvvigionamento d’acqua”.
Norme
- Reg. 625/2017 del 15 marzo 2017 relativo ai controlli ufficiali e alle altre attività ufficiali effettuati per garantire l’applicazione della legislazione sugli alimenti e sui mangimi.
- Reg. 396/2005 del 23 febbraio 2005 concernente i livelli massimi di residui di antiparassitari nei o sui prodotti alimentari e mangimi di origine vegetale …
- EN 15662:2008 – Foods of plant origin – Determination of pesticide residues using GC-MS and/or LC-MS/MS following acetonitrile extraction/partitioning and clean-up by dispersive SPE – QuEChERS-method
- EN 15662:2018 – Foods of plant origin – Multimethod for the determination of pesticide residues using GC- and LC-based analysis following acetonitrile extraction/partitioning and clean-up by dispersive SPE – Modular QuEChERS-method
Per saperne di più
- EURL, https://www.eurl-pesticides.eu
- CVUA, https://www.cvuas.de
- EFSA, https://www.efsa.europa.eu/it
- Ministero della Salute, https://www.salute.gov.it
- Istituto Superiore di Sanità, https://www.iss.it
- ECHA, https://echa.europa.eu/it/
Bibliografia
[1] RT-08, Prescrizioni per l’accreditamento dei laboratori di prova, Rev. 05 del 15-12-2021
[2]SANTE/12682/2019, Procedure analitiche di controllo della qualità e di convalida del metodo per l’analisi dei residui di pesticidi negli alimenti e nei mangimi
[3] Anastassiades M, Lehotay SJ, Stajnbaher D e Schenck FJ, Metodo multiresiduo facile e veloce che impiega estrazione/partizionamento con acetonitrile ed estrazione dispersiva in fase solida per la determinazione dei residui di pesticidi nei prodotti, Roma, 2002
[4] M. Anastassiades, SJ Lehotay, D. Stajnbaher, FJ Schenck, JAOAC Int 86(2) 412-31
[5] QuEChERS, Storia, https://www.quechers.com/method1.htm
[6] Lehotay, SJ, K. Mastovska, et al., J AOAC Int 88(2): 615-29
[7] QuEChERS – Un importante multi-metodo nell’analisi dei pesticidi, CVUA Soccarda, https://www.cvuas.de
[8] CVUA Stoccarda, QuPPe – Nuovo metodo multiplo nell’analisi dei pesticidi, https://www.cvuas.de
[9] Rapporto Istisan 19/7, Metodi analitici per il controllo delle acque da destinare e destinate al consumo umano ai sensi del DL.vo 31/2001 e s.m.i. Metodi chimici. A cura di Luca Lucentini, Marina Patriarca
[10] ENVIRONMENTAL FATE OF GLYPHOSATE Jeff Schuette Environmental Monitoring & Pest Management Department of Pesticide Regulation Sacramento, CA 95824-5624 (Revised November 1998)
[11] Water Monitoring Program: LC-HRMS method for Glyphosate analysis, M. Mazzetti, V. Filippi, L. Patricelli, S. Menichetti, P. Altemura, ArpaT
[12] Il monitoraggio dei pesticidi in Italia fa acqua da tutte le parti,Alessandro Franchi e Michele Lorenzin per greenreport.it
[13] Unichim, Manuale 179/0,Linea guida per la convalida di metodi analitici nei laboratori chimici, criteri generali, edizione 2011
Scritto il 22.02.2022
Autore Marco Morelli

